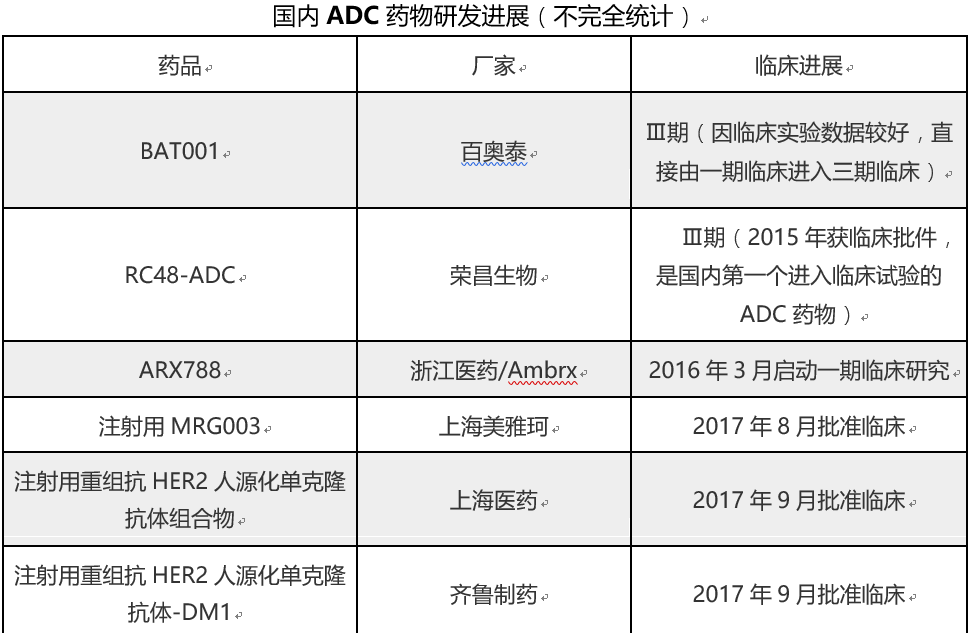
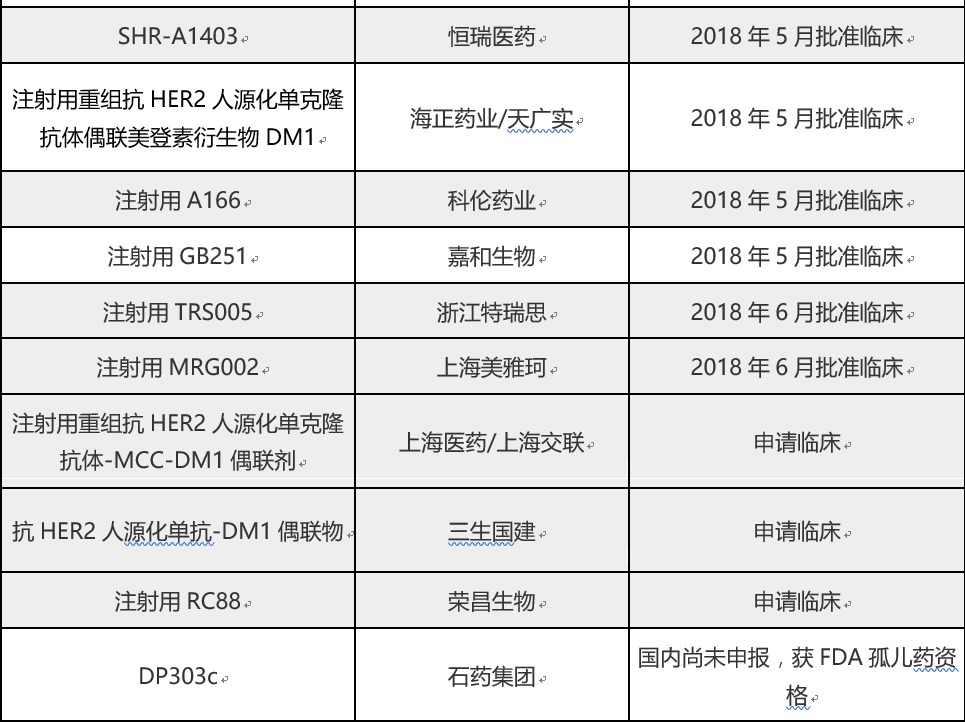
浙江特瑞思药业和上海美雅珂研发的抗体偶联药物“注射用TRS005”及“注射用MRG002”办理状态已变更为“制证完毕-待发批件”,这也意味着这两款药物即将获得临床试验批件。据财联社统计,最近一个月里国内有6款抗体偶联药物获准临床试验。
浙江特瑞思药业和上海美雅珂研发的抗体偶联药物“注射用TRS005”及“注射用MRG002”办理状态已变更为“制证完毕-待发批件”,这也意味着这两款药物即将获得临床试验批件。据财联社统计,最近一个月里国内有6款抗体偶联药物获准临床试验。
5月7日,海正药业(600267.SH)研发的“注射用重组抗HER2人源化单克隆抗体偶联美登素衍生物DM1”获CFDA批准在国内展开临床试验。
5月8日,沃森生物(300142.SZ)和康恩贝(600572.SH)参股的嘉和生物(两者分别持股68.47%和21.05%)研发的“注射用GB251”获准临床试验。
5月12日,科伦药业(002422.SZ)公告称,控股子公司四川科伦博泰生物医药股份有限公司开发的抗体偶联药物-“注射用A166”继FDA允许开展临床试验后,又获CFDA核准签发的《药物临床试验批件》。
5月17日,恒瑞医药(600276.SH)研发的ADC药物-“注射用SHR-A1403”亦获准进入临床试验。恒瑞该款ADC药物还在2017年初获得美国FDA批准临床。
抗体偶联药物(antibody-drug conjugate,ADC)是现今抗体药物研发的前沿领域,由单克隆抗体和强效毒性药物通过生物活性连接器偶联而成,是一种融合了小分子药物细胞毒性和抗体靶向作用的强效抗癌药物,又被称为“智能生物导弹”。
由于种种原因,ADC行业在过去几年一直处于低谷期。在2017年以前,全球仅有两款上市药物,且都用作二线用药,销量有限。但得益于ADC关键技术如偶联技术的突破和进步,从2017年开始,整个行业开始出现回暖迹象,如现有上市产品适应症逐步增加、曾经历退市的第一个ADC药物Mylotarg在调整了给药剂量、时间间隔和病人群体,并通过临床验证后又重新上市,同时又有新的产品(辉瑞Besponsa)上市等。
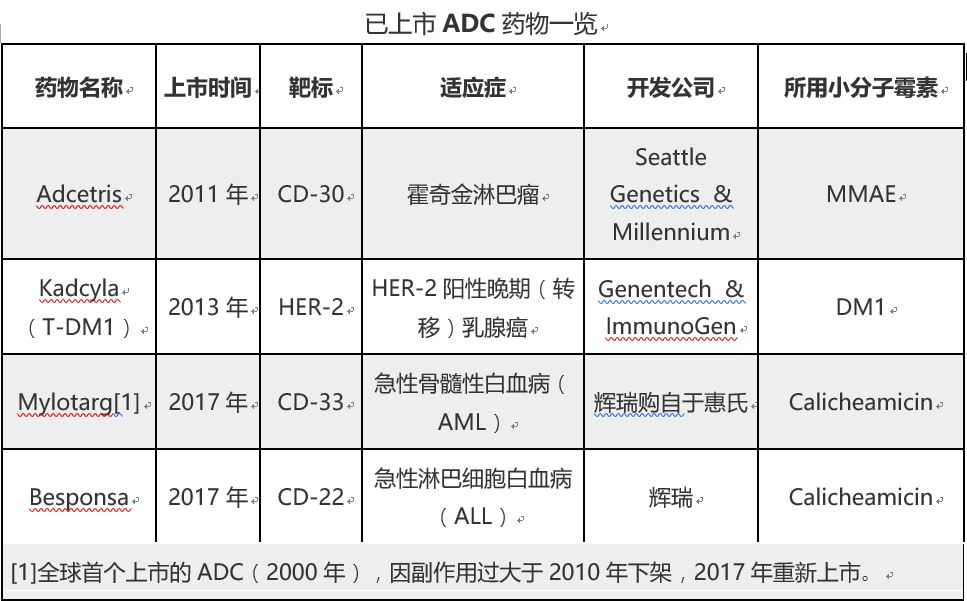
业内认为,未来,受益于定点定量偶联技术、更新更优秀的小分子毒素的开发应用、以及抗体修饰技术的完善等方面的新突破,加上癌症联合疗法的大势所趋,ADC技术有望步入大规模应用阶段,整个产业也将步入新的发展阶段。
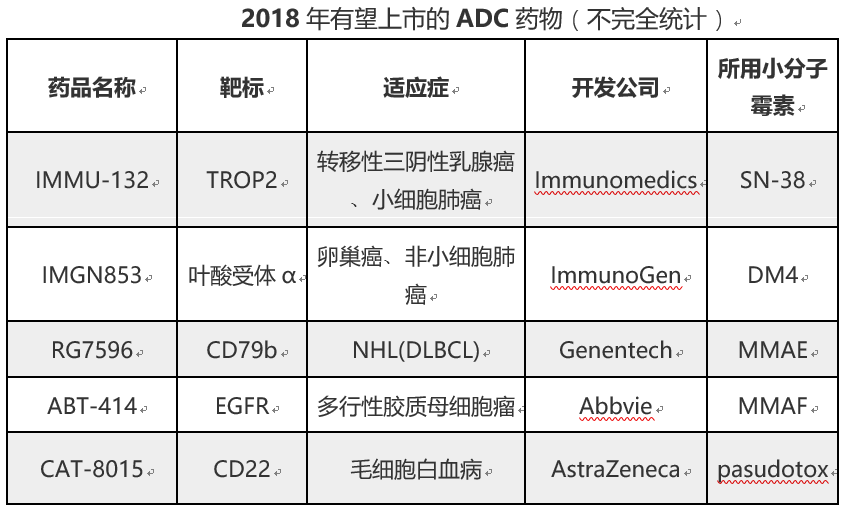 目前国内尚无ADC药物被批准上市,但已布局该领域的公司则不少,有至少20多家。除了前面提到的几家企业外,还有荣昌生物、浙江医药(600216.SH)、上海医药(02607.HK)、石药集团(01093.HK)等。另外,华海药业(600521.SH)、贝达药业(300558.SH)也通过投资杭州多禧生物科技有限公司布局ADC药物,分别持有后者约9%和1.6%的股份。据了解,杭州多禧生物科技有限公司首款ADC药物也将在今年申报临床。(财联社记者 徐红)
目前国内尚无ADC药物被批准上市,但已布局该领域的公司则不少,有至少20多家。除了前面提到的几家企业外,还有荣昌生物、浙江医药(600216.SH)、上海医药(02607.HK)、石药集团(01093.HK)等。另外,华海药业(600521.SH)、贝达药业(300558.SH)也通过投资杭州多禧生物科技有限公司布局ADC药物,分别持有后者约9%和1.6%的股份。据了解,杭州多禧生物科技有限公司首款ADC药物也将在今年申报临床。(财联社记者 徐红)